

得獎心得
離夢想有多遠?公費醫師服務終於結束了。前天,台灣腦中風學會秘書以電話告知我再度獲得「杜世彬博士紀念論文獎」之榮譽,這是台灣神經學界每年度最重要的獎項之一。回首過去,驕傲的是,在這六年公費醫師服務期間以署立醫院為名發表了十餘篇SCI國際期刊論文,榮耀自己的機構,自己從一個剛考過專科醫師的菜鳥轉變成博士與助理教授,也從單身螁變成擁有兩個小孩的天才老爸。一個默默無聞的基層醫師竟然連續三次得到腦中風學會優秀論文獎肯定,是的,「世界有多遠、心就有多寬」。 但是,難過與不捨的卻是永不回頭的青春歲月,時間幾乎偷走所有選擇…
背景和目的
目前預防腦中風的發生僅以藥物控制內科危險因子為主,如果這些危險因子通通控制好, 約可將整體腦中風機率降低百分之八十五。但是,剩下的百分之十五難道就束手無策坐以待斃[1]?事實上,先天性腦血管變,一如椎動脈發育不全/前大腦動脈A1段發育不全及後交通動脈發育不全,被認為是腦中風的解剖學危險因子。
先天性腦血管變如威爾氏環的變異缺損為一並不罕見的解剖學現象,盛行率約在2%至15%之間。我們研究的目的在進一步闡明這些腦部先天性血管變異於腦中風的角色。我們嘗試以定量的方法探討腦部先天性血管變異的生理意義。我們分析頸動脈支架放置前後一週威爾氏環的形態學改變,以瞭解威爾氏環變異的血流動力學意函。Klijn等人[1] 說明為什麼嚴重的頸動脈狹窄患者可能會沒有症狀的原因,是因為威爾氏環提供側支循環以彌補腦血流量的減少。威爾氏環被認為是主要的側支循環途徑。 Hoksbergen等人[2]記載只有約50%的一般民眾有一個完整的威爾氏環;可能的解剖變異如先天發育不全等是很常見的。後交通動脈發育不全是最早被公認為腦中風的解剖學危險因子[3]. Schomer [3]和莊等人[4]描述後交通動脈(PCoA)發育不全和A1發育不全可能附帶增加缺血性腦梗塞的危險因子。因此,有人建議該等解剖風險因素應被早期識別。筆者就國人腦中風族群做的研究中發現腦中風病患椎動脈發育不全與同側腦幹梗塞有關,前大腦動脈A1段發育不全與同側基底核梗塞有關[4],及後交通動脈發育不全與同側視丘梗塞有關,並且這些先天性腦血管變異在腦中風病患之盛行率遠較正常對照組為高,顯示就國人而言,這些先天性腦血管變異確實可能是腦中風的解剖學危險因子。但是,Liebeskind 和 Sansing [5]描繪威爾氏環的動態轉換,原本看不見的後交通動脈PCoA 會在逐步右中腦動脈狹窄中重新出現。Kablak Ziembicka等人[6]描述頸動脈狹窄再開通後前交通動脈側支流循環的血流動力學轉型。因此之前的PCoA和A1發育不良的病理意義需要進一步驗證,必須確定威爾氏環是否是靜態假定或是一變動的參數。
較近期的威爾氏環亞段很容易可以藉由磁共振造影(MRA;直徑<1毫米)來加以定義[3]。因此,我們針對頸動脈狹窄患者接受頸動脈支架術前後進行一項縱向研究。我們假設威爾氏環可能不是一個靜態的假定, 而是一個可隨血流動力學參數更改而變動的結構。
方法與病患收集
從2005年到2007年醫院進行的71位頸動脈支架術病人,(含41名男子,平均年齡62.8 ± 8.6年,範圍 44–82)。追溯病人的所有記錄,我們將納入標準訂為:(1)頸動脈狹窄>70%,(2)頸動脈支架放置前後一週後可成功完成磁振造影血管攝影, (3) 對側頸動脈從未接受頸動脈內膜切除術或頸動脈支架術。6位病患因記錄不完整被排除,(三位不能容忍術後磁共振成像檢查,兩位曾接受對側頸動脈支架,一位曾接受對側頸動脈內膜切除術)。因此,我們為65例病患進行磁振造影血管攝影。威爾氏環的圖像由兩位調查員進行獨立評價。
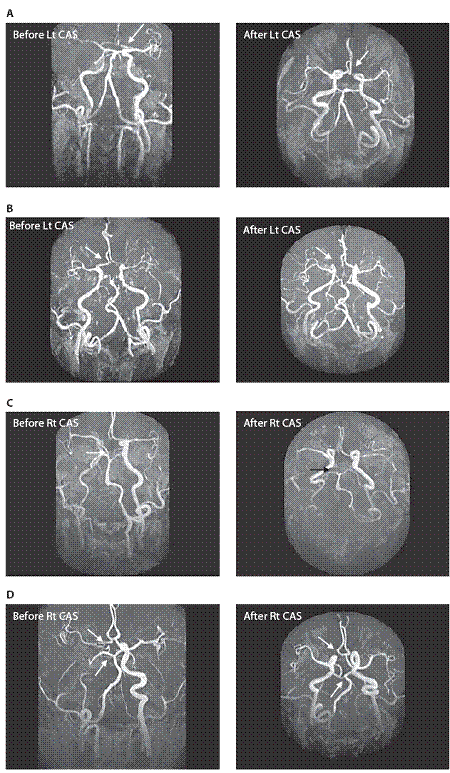
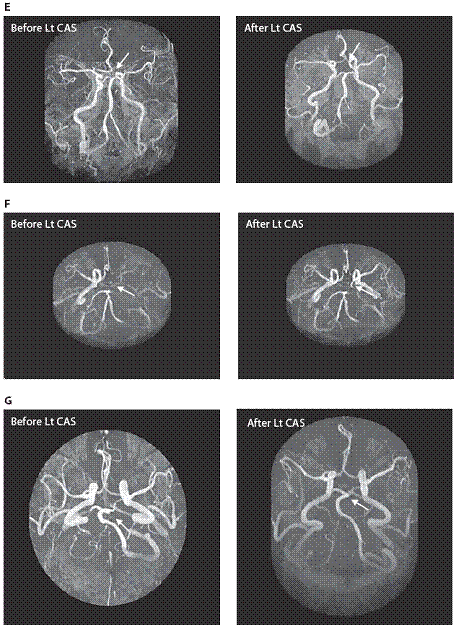
測試標的為用來比較不同威爾氏環形態與患者子群之間的個案數位差異的統計分析。 術前磁振造影完整威爾氏環的盛行率與術後進行比較。術後<消失>的威爾氏環段與術後<開啟>威爾氏環亞段數相比。威爾氏環前迴圈的重新分配亞段數與重新分配的威爾氏環後迴圈相比。表一所示結果的基準特徵,65位病人及腦缺血性事件和在不同的檢查之間的時間間隔。基線和術後的腦磁形貌的概述載于表一。
結果
基線腦磁形貌顯示完整的威爾氏環只有11例(16.9%);大多數(n = 54)有不完整的威爾氏環(83.1%)。術後的腦磁形貌顯示20例(30.7%)具完整的威爾氏環,因此,完整的威爾氏環的概率在術後較高(p = 0.03)。三分之一的病患在術後威爾氏環有了包括7種不同模式的顯著形態改變(表二和圖1 A–G)。包括支架放置後同側(對側)A1段/後交通動脈/P1段消失,支架放置後開啟了同側A1段/後交通動脈/P1段,其餘部分(64.62%)維持不變。整體而言, 威爾氏環段<消失>的比率較<開啟>為高(p = 0.021)。此結果暗示威爾氏環的作用主要為代償供應頸動脈狹窄,當頸動脈狹窄改善後,威爾氏環代償供應的需求便消滅,威爾氏環前迴圈的重新分配亞段數與重新分配的威爾氏環後迴圈相比,前迴圈威爾氏環概率占60%,高於威爾氏環後迴圈PCoA(p = 0.025)。
討論
基於此一小規模、縱向研究的結果,我們解釋後威爾氏環解剖功能的變化可能起因性於磁振造影血管攝影假陰性或假陽性結果。威爾氏環節段性發育不全不是只有一個變數的功能,但也模仿一種自我調整的電容,威爾氏環節段性發育不全被視為一個自動調節機制[8]的一個部分。另一方面,本研究也顯示,威爾氏環磁振造影血管攝影上形態學並非恆定,所以單憑一次的威爾氏環磁振造影血管攝影以判斷是否是發育不全並不可靠。此結果暗示威爾氏環的作用主要為代償供應頸動脈狹窄,當頸動脈狹窄改善後,威爾氏環代償供應的需求便消滅。
我們想強調,威爾氏環的調控關鍵點是<開啟>比<關閉>更重要。腦內威爾氏環的流動與否取決於腦內代謝需求與下游阻力[9],不只是上游壓力。我們想強調,威爾氏環的調控關鍵點是取決總模式的血流量,重要的是,不是個別一個領域。 換言之,一旦一開始考慮總模式的血流量,必須考慮所有可能附帶來源[2]。但是,威爾氏環前迴圈的重新分配亞段數與重新分配的威爾氏環後迴圈相比,前迴圈威爾氏環概率占60%高於威爾氏環後迴圈PCoA。
前迴圈的重新分配作為一個主要的現象。我們的解釋是一個自動調節功能效率的前、 後路迴圈之間的差異。Fisher [10] 所述蝶齶神經節主要調節中的威爾氏環的前三分之二的血管舒縮活動。因此,在前迴圈腦自動調節功能[11]具體快速神經血管交互方式之優勢。 我們觀察到威爾氏環節段性發育不全不是靜態的發現挑戰Schomer等人[3]和[4]莊等人的想法。他們的研究設計和診斷威爾氏環節段性發育不全只基於單一次的磁振造影血管攝影。他們所認定之PCoA和A1發育不全的病理意義僅從一單純靜態的觀察。有必要調整時所假設的解剖學的危險因素。Schomer等人[3]應修訂說自動調節功能未能及時招聘PCoA作為側支循環才是一個危險因素。可惜的是,目前並沒有很好的手術可以矯正這些先天性腦血管發育不全。但是,早期發現這些先天性腦血管發育不全代表著容易發展腦中風的體質,更應加強內科危險因子的控制如高血壓等必須除惡務盡。根據以上研究,我們提出以下結論:在腦梗塞的受試者中威爾氏環及椎動脈磁振造影血管攝影中的血管性變異確實較高,這些血管變異可透過慢性缺血性損傷及弱化側支循環功能而達到誘發腦梗塞,但由於磁振造影血管攝影中威爾氏環的形態並不恆定,所以需要更好的操作型定義來界定先天性血管變異。

參考文獻