

部小血管疾病 (cerebral small vessel disease) 是自發性腦出血之主要病因,最常見的種類包括影響腦部深處小血管之高血壓性腦血管病變(hypertensive angiopathy, HA),和影響腦膜與腦表面小血管之大腦類澱粉血管病變 (cerebral amyloid angiopathy, CAA)。傳統上,我們會依據腦出血的位置來幫助區分此兩種常見之小血管病變,比方說,靠近腦葉的出血傾向是CAA,而腦中深處如基底核或視丘的出血則是偏向HA造成。
近年來,由於磁振造影技術之進步,臨床上可使用血液敏感之sequence,如Susceptibility-weighted imaging (SWI) 或是T2* gradient echo (GRE)來偵測腦中之微小出血或是其他的出血性病灶,其中最著名的就是腦部微出血 (cerebral microbleed, CMB) 以及皮質表面血鐵質沉積(cortical superficial siderosis, cSS)。
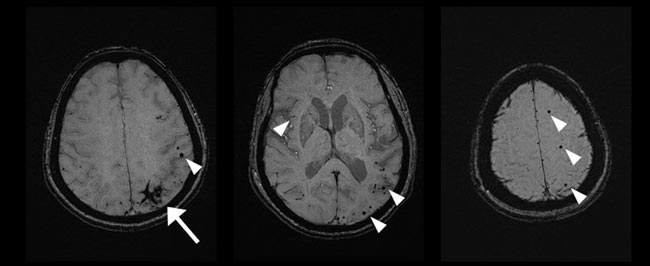
圖一:CAA之磁振造影表現,可見大葉型腦出血(箭頭)與侷限在皮質與腦葉之微出血(三角形)。
在CAA病人身上,CMB分佈會侷限在皮質與腦葉處,並且常合併單一或多發之cSS; 相對於HA的病人,CMB則通常侷限在腦部深處,且不會看到cSS之病灶(圖一)。
然而,小血管疾病不單只會造成腦出血,它還有另一個著名的臨床表現為裂隙型梗塞(lacunar infarct) [1]。裂隙型梗塞常被認為是高血壓性血管病變的一種病徵,會在磁振造影上看到被腦脊髓液充滿的小空腔 (約3-15毫米),並且多分佈在腦部深處。然而,早年之病理報告也發現這些裂隙型梗塞也會出現在更表面的位置,如腦部之白質或是半卵圓中心 (centrum semiovale),而這些裂隙型梗塞之成因其實並不清楚。因此,我們收集了臺大醫院共110位自發性腦出血患者,其中24位為CAA,86位為HA,並分析其腦部影像學之表現。根據我們的研究結果,分佈在腦白質中的裂隙型梗塞 (lobar lacune),更常在CAA當中看到 (29.2 versus 11.6%; P=0.036)。在多變項回歸分析的模式之下,lobar lacune也與腦部皮質CMB的出現獨立相關 (p=0.011) [2]。我們知道,皮質CMB是CAA的一重要特徵,此一結果暗示了lobar lacune與CAA之相關性。
除了磁振造影之外,類澱粉正子攝影是另一重要之分子影像學工具,它不僅僅能在人體偵測大腦實質之類澱粉沈積,也可以偵測血管之類澱粉沈積(圖二) [3,4]。因此,除了應用在阿茲海默氏症之診斷之外,也可以應用在CAA之診斷與研究之上。在我們此篇研究當中,其中36位患者除了磁振造影之外,也接受了類澱粉正子攝影之檢查 (PiB PET),在這群病患當中的分析顯示,腦部PiB的顯影含量顯著地與lobar lacune的數目相關 (ρ=0.40; P=0.02),更進一步確立了lobar lacune與CAA之關聯性(圖三)。
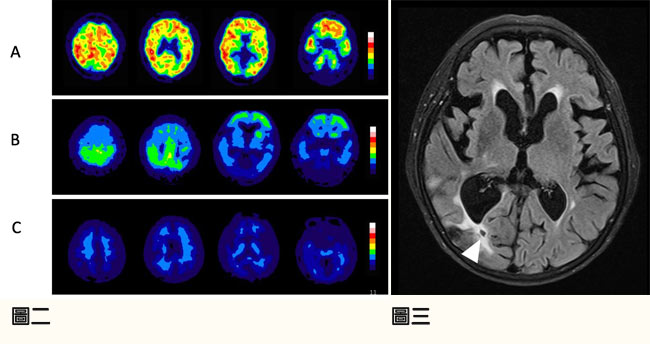
圖二:類澱粉正子造影於(A) 阿茲海默氏症,(B) 類澱粉血管病變,(C)正常受試者。
圖三:CAA患者之裂隙型梗塞,位於腦部後方之大腦白質處(三角形)。
我們的研究是目前少數發表探討CAA與lobar lacune之相關性的文章 [2,5],這樣的結果也將CAA除了出血性病灶的表現之外,擴展到缺血性的表現。其實除了lacune,腦部白質病變 (white matter hyperintensity) 也有人認為是一種慢性缺血狀態而導致之影像學變化,而這些缺血性病灶與認知功能障礙或甚至是步態障礙都很有關係。了解這些病灶背後之疾病生理機轉,對於未來如何治療這一群病人,可以說是相當有貢獻。
參考文獻